PRTIMES
一般社団法人 日本臨床培養上清研究会(事務局所在地:東京都文京区、理事長:野村 紘史)は、2022年10月14日(金)に幹細胞培養上清の臨床における安全性を審査する「臨床培養上清安全性審査委員会」(委員長:田中 善)を発足しました。
国内の自費診療クリニックなどで普及している幹細胞培養上清の安全性を臨床の視点から審査する、国内で初めての審査機関となります。
今後、同委員会は幹細胞培養上清の製造施設からの申請にもとづき、新規に作成された「幹細胞培養上清安全性基準」に則って幹細胞培養上清の安全性を審査し、製造施設の承諾を得た製品に関してその結果をホームページ等で公開していきます。
【URL】https://jssccs.org
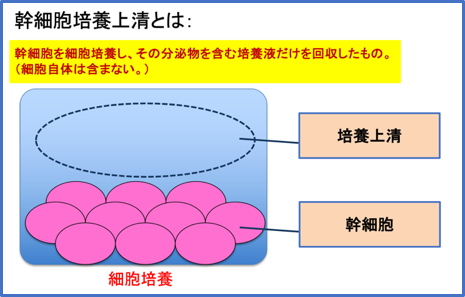
幹細胞培養上清とは
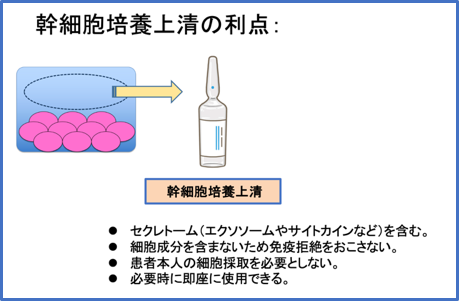
幹細胞培養上清は幹細胞を培養する際の培養液の上澄み液です。
その中には幹細胞が分泌するセクレトーム(サイトカインやエクソソームなど)と呼ばれる成分を含有していて、これらの成分が治療において作用すると考えられています。
幹細胞培養上清は細胞を含まないため、他者の幹細胞を培養して製造した幹細胞培養上清であっても、細胞による免疫拒絶の反応を起こしません。つまり患者本人の幹細胞を採取したあとに時間をかけて培養する必要なく、前もって製造した幹細胞培養上清を保存しておくことができます。このような特徴から、幹細胞培養上清を製造する施設や企業が多数存在し、自費診療のクリニックなど国内の医療施設でさまざまな疾患治療や美容、健康増進、アンチエイジングなどを対象に、幹細胞培養上清を用いた治療が普及しています。
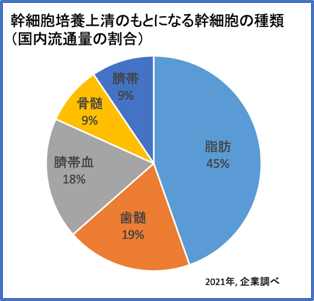
幹細胞培養上清には、製造する際のもとになる幹細胞の種類によって複数の種類があります。
現在国内で流通している幹細胞培養上清のもとになる幹細胞としては、
脂肪組織由来幹細胞、歯髄由来幹細胞、臍帯血由来幹細胞、骨髄由来幹細胞、臍帯由来幹細胞などがあります。幹細胞培養上清中に含まれるエクソソームやサイトカインの種類や量、比率などは細胞の種類によっても、
細胞培養の条件などによっても異なります。
幹細胞培養上清は医薬品として承認されているものではありませんが、
自費診療のクリニックで以下のようなさまざまな目的の治療に使用されています。
幹細胞培養上清が持つ潜在的な医学的価値と、安全性に関する現在の状況
<潜在的な医学的価値>
幹細胞を用いた再生医療は、先端的な医療技術として長年注目を集めています。なかでも、脂肪組織由来幹細胞や骨髄由来幹細胞などの間葉系幹細胞は、ほかの種類の幹細胞にないユニークな性質を持ち、比較的早くから実際の臨床使用が実現しています。
そして間葉系幹細胞が持つユニークな性質は、元来考えられていたように幹細胞自体が損傷した細胞を補充するためにその細胞に置き換わるだけでなく、間葉系幹細胞が分泌する物質が組織の損傷を修復したり疾患を治療する効果があることが多数の研究により解明されてきました。これをパラクライン効果(または栄養効果)と呼び、分泌される物質を総称してセクレトームと呼びます。
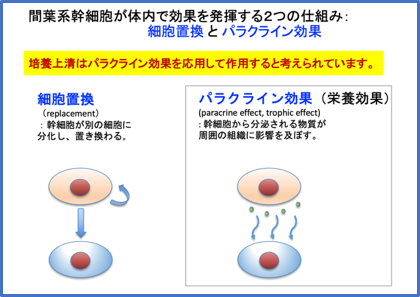
幹細胞培養上清は、細胞そのものは含めずに、細胞が分泌する成分だけを集めて、このパラクライン効果を利用したものと言えます。
細胞そのものを含まないので、輸血や臓器移植のような免疫拒絶の危険性がありません。そのため、必ずも治療を受ける患者様本人の細胞を使用する必要がなく、前もって別の方の細胞を用いて幹細胞培養上清を製造、保管しておくことができます。
幹細胞を用いた再生医療は、細胞を採取し培養するのに数週間の
準備期間を要しますが、幹細胞培養上清は必要な時にすぐに治療が
おこなえる利点もあります。さらに、培養工程の調整により製造コストを下げることが可能で、一般に幹細胞を
用いた再生医療よりも安い料金で治療を受けることができます。
現在日本で再生医療を規定する法律(再生医療等安全性確保法)では、幹細胞を利用した細胞治療(cell based
therapy)は再生医療に分類されますが、幹細胞培養上清を用いた治療は再生医療には分類されません。しかしながら幹細胞のセクレトームを利用した治療は前述のようなさまざまな利点を持つため、細胞を用いない治療(cell free therapy)として、次世代の再生医療技術として期待が高まっています。
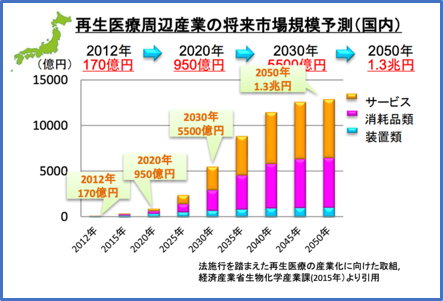
このような新規技術も含めた再生医療周辺産業の将来市場規模予測は2030年には国内市場5500億円、世界市場
5.2兆円、さらに2050年には国内市場1.3兆円、世界市場15兆円と産業的にも継続的な発展が見込まれています。
世界的な視野で見ると、セクレトームの一種であるエクソソームは、単一の成分を抽出して医薬品として開発する方向で研究が進んでいます。また、サイトカインのうち数種類は、単一の成分の医薬品として国内でも治療に使用されています。
幹細胞培養上清はこれらのエクソソームやサイトカインを総体として含む混合物であり、幹細胞が持つ再生医療の治療効果を発揮できる可能性が期待されています。
<幹細胞培養上清の安全性>
前述のように幹細胞培養上清は再生医療等安全性確保法によって再生医療には規定されていません。また、単一の成分ではなく混合物であるため、医薬品を規定する法律(医薬品医療機器等法)では医薬品にも分類されません。そのため、現在は研究用試薬として製造、販売され、医療機関において医師の裁量のもと治療に利用されているのが一般的です。幹細胞を利用した再生医療と異なり、法に基づく所定の手続きなども不要なため、多くの医療機関に普及しています。
しかし一方で、安全性を含めた幹細胞培養上清の品質を確認する基準も存在しなかったため、治療に際して本当に安全性が保たれているかの懸念があります。
幹細胞培養上清には原理的に細胞による免疫拒絶はないとはいえ、ウイルス感染症が起きる危険がないとは言いきれず、感染症チェックは重要です。また、細胞培養や保存、輸送の工程で品質が保たれているかも、安全性の観点からも不可欠です。
これまではこれらの内容に関する基準がなかったため、医療機関から製造施設・企業へのフィードバックも不足しており、臨床成績の研究・議論やより良い製品の開発を潜在的に阻害し、患者様の治療の安全性にも影響が出る可能性がありました。
<幹細胞培養上清とヒト幹細胞コスメの違い>
化粧品の分野ではヒト幹細胞コスメが以前から普及しています。ヒト幹細胞コスメの原料には「〇〇細胞順化培養液エキス」などが含まれていますが、これは一般的に幹細胞培養上清そのものではなく、化粧品の安全性試験に適合するために幹細胞培養上清にその他の成分を混合して安定化させたものです。
実際の医療において幹細胞培養上清が皮膚の深部まで注入されたり、点滴などで血管内に投与されることを考えると、臨床に用いられる幹細胞培養上清にはより厳密な安全性基準が必要と言えます。
幹細胞培養上清液安全性基準 と 臨床培養上清安全性審査委員会
臨床培養上清安全性審査委員会では、以下の5つの大項目からなる幹細胞培養上清安全性基準に照らして、個別の幹細胞培養上清製品の安全性を審査します。
<各項目の解説>
I. 細胞提供者の安全性、倫理性配慮
幹細胞培養上清は、幹細胞を培養する過程で製造されます。そのため、まず最初に幹細胞が必要であり、人体からの細胞を使用する場合には提供していただく細胞提供者がいることになります。この細胞提供者の安全性や倫理的な手続きは確実に配慮される必要があります。
II. 感染症に対する安全性
細胞はもともと生物由来のものであり、ウイルス感染症のリスクを極力排除するためにしかるべき検査が必要です。また、培養工程中にマイコプラズマや細菌の混入がないかの確認も必要となります。
III. 培養工程の安全性
幹細胞培養上清は生きた細胞の培養工程を経て製造されるため、製造ロットごとに必ずしも同じ品質の製品が製造されるとは限りません。そのため培養工程自体のプロトコルの確実性や、無菌操作の徹底、品質管理の体制などが重要になります。
IV. 保存安定性、輸送管理における安全性
幹細胞培養上清にはエクソソームやサイトカインなどのセクレトームに加え、培養液由来の成分や培養工程で必要になる試薬などの成分も含まれています。製造後、実際に臨床で使用されるまで適切な環境条件で保存され、輸送される必要があります。
V. 安全性に関する情報開示、トレーサビリティー
製品の安全性に関する情報は適切に医療期間および最終的なユーザーである患者様に情報開示されるべきです。幹細胞培養上清は先端的な分野であるため、今後の研究の進展に伴い、安全性基準も適宜更新されていく可能性があります。どのような基準での審査であるかも含めた情報開示が重要となります。また、製品がロットごとに必ずしも同等でない可能性を織り込み、製品ロットを適切に追跡、記録しておくトレーサビリティーも必要となります。

これらの5つの大項目にはそれぞれ具体的な審査内容を含みます。臨床培養上清安全性審査委員会がこれらを審査し、以下の評価法で評価します。項目ごとの評価を総合して総合評価とします。
【幹細胞培養上清液安全性基準のURL】https://jssccs.org/committee/
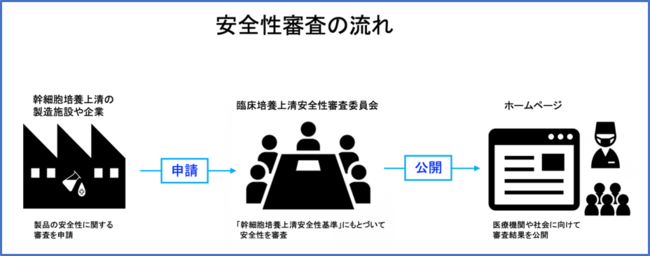
<幹細胞培養上清 安全性審査の具体的な流れ>
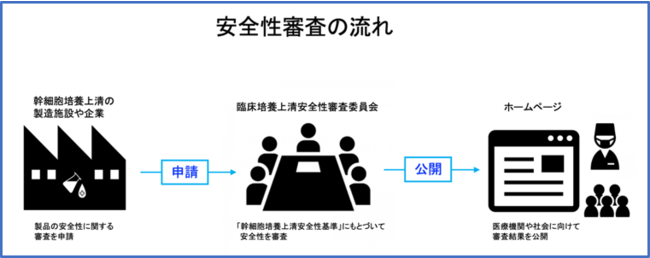
安全性審査は、幹細胞培養上清を製造している製造施設・企業からの申請にもとづいておこなわれます。
審査の申請手続きは、ホームページからおこなうことができます。
【安全性審査申し込みのURL】https://jssccs.org/committee/
臨床培養上清安全性審査委員会で審査をおこなったのち、製造施設の承諾を得た製品に関しては、その審査結果は日本臨床培養上清研究会のホームページで公開されます。
今後の活動予定
これまで幹細胞培養上清に関する安全性の基準が存在しないにも関わらず、実際の医療において幹細胞培養上清が数多く使用されてきました。共通の基準ができることにより、今後は臨床医、研究者、培養上清製造施設・企業などの議論が進み、さらに幹細胞培養上清液安全性基準も改善されていくと思われます。また、臨床・研究・産業の情報交換が促進されることにより幹細胞培養上清の有効性やさまざまな疾患へのより良い治療法の解明も進むことが期待されます。
臨床培養上清安全性審査委員会の活動内容に関して、2022年11月19日、20日に京都府立 京都学・歴彩館で開催される日本先制臨床医学会 第5回学術大会において当研究会理事長の野村が発表を予定しています。
幹細胞培養上清液安全性基準をきっかけに、臨床・研究・産業の協議が促進する架け橋となるべく、今後さまざまな方面に本取り組みを周知してまいります。
担当者コメント
一般社団法人 日本臨床培養上清研究会 事務局 担当・飯田 コメント
幹細胞培養上清は非常に先端的な分野で、その治療効果が期待されています。適切に安全性が評価できるようになることで、患者さんも安心して治療が受けられるようになり、医学的にも産業的にもインパクトがとても大きい取り組みと考えています。ぜひ多くの方に幹細胞培養上清に関する情報と安全性評価についてお知りいただき、製造企業の関係者の方々には審査申請をご検討いただければ幸いです。
一般社団法人 日本臨床培養上清研究会について
日本臨床培養上清研究会は、臨床での培養上清の品質、信頼性、効率性の向上を目的とする研究会です。
幹細胞培養上清を製造する施設や企業の申請に基づき、臨床的な視点から幹細胞培養上清の安全性を審査し、患者様や医療機関が安全性の高い幹細胞培養上清製品で治療がおこなえるように、その内容を医療機関や社会に向けて公開いたします。
また、幹細胞培養上清に関する正しい情報を社会に発信していくとともに、医師や研究者、幹細胞培養上清に関わる企業等の情報交換の促進を支援し、培養上清をもちいた医療の質の向上に貢献します。
【研究会概要】
名称 :日本臨床培養上清研究会
所在地 :東京都文京区本郷3-42-1-3F
理事長 :野村 紘史
事業内容 :幹細胞培養上清製品の安全性評価および幹細胞培養上清に関する情報発信と情報交換の促進
設立 :2022年9月28日
HP :https://jssccs.org/
企業プレスリリース詳細へ
PR TIMESトップへ

SKINCARE
PR

SKINCARE
PR

SKINCARE
PR

HAIR
PR

SKINCARE
PR

SKINCARE
PR

SKINCARE
PR

SKINCARE
PR

2026年3月16日(月)23:59まで

2026年3月16日(月)23:59まで

2026年2月16日(月)23:59まで

2026年2月16日(月)23:59まで

2026年1月16日(金)23:59まで